普通口服固体制剂溶出度试验
技术指导原则
一、前言
本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景
固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:
1.评价药品批间质量的一致性;
2.指导新制剂的研发;
3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统
根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):
1类:高溶解性–高渗透性药物
2类:低溶解性–高渗透性药物
3类:高溶解性–低渗透性药物
4类:低溶解性–低渗透性药物
上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。在37±1℃下,测定**高剂量单位的药物在250mL pH值介于1.0和8.0之间的溶出介质中的浓度,当药物的**高剂量除以以上介质中的药物浓度小于或等于250mL时,可认为是高溶解性药物。一般情#p#分页标题#e#况下,在胃肠道内稳定且吸收程度高于85%或有证据表明其良好渗透性的药物,可认为是高渗透性药物。
在禁食状态下,胃内滞留(排空)T50%时间为15∼20分钟。对于高溶解性-高渗透性(1类)及某些情况下的高溶解性-低渗透性(3类)药物制剂,以0.1mol/L HCl为介质,在适当的溶出度试验条件下,15 分钟的溶出度大于85%时,可认为药物制剂的生物利用度不受溶出行为的限制,即制剂的行为与溶液相似。在这种情况下,胃排空速度是药物吸收的限速步骤。如果药物制剂溶出比胃排空时间慢,建议在多种介质中测定溶出曲线。
对于低溶解性-高渗透性药物(2类),溶出是药物吸收的限速步骤,有可能建立较好的体内外相关性。对于此类制剂,建议在多种介质中测定溶出曲线。
对于高溶解性-低渗透性药物(3类),渗透是药物吸收的限速步骤,可能不具有好的体内外相关性,吸收程度取决于溶出速率与肠转运速率之比。
对于低溶解性-低渗透性药物(4类),制备口服制剂比较困难。
四、溶出度标准的建立
建立体外溶出度标准的目的是保证药品批间质量的一致性,并提示可能的体内生物利用度问题。对于新药申请,应根据可接受的临床试验样品、关键生物利用度试验和/或生物等效性试验用样品的溶出数据以及药品研发过程中的经验,确定溶出度标准。如果稳定性研究批次、关键临床试验批次及拟上市的样品生物等效,也可根据稳定性研究用样品的数据制定溶出度标准。
对于仿制药申请,应根据可接受的生物等效性试验用样品的溶出数据,确定溶出度标准。一般仿制药的溶出度标准应与参比制剂一致。如果仿制药的溶出度与参比制剂存在本质差异,但证明体内生物等效后,该仿制药也可建立不同于参比制剂的溶出度标准。建立了药品的溶出度标准后,药品在有效期内均应符合该标准。
普通口服固体制剂可采用下列两种溶出度控制方法:
1.单点检测
可作为常规的质量控制方法,适用于快速溶出的高溶解性药物制剂。
2. 两点或多点检测
(1)可反映制剂的溶出特征。
(2)作为某些类型药物制剂的常规质量控制检验(如卡马西平等水溶性差且缓慢溶解的药物制剂)。
采用两点或多点溶出度检测法,能更好地反映制剂的特点,有助于质量控制。
(一)新化合物制剂溶出度标准的建立
考察药物制剂的溶出度特征应考虑药物的pH-溶解度曲线及pKa,同时,测定药物的渗透性或辛醇/水分配系数可能有助于溶出方法的选择和建立。应采用关键临床试验和/或生物利用度试验用样品的溶出度数据作为制定溶出度标准的依据。如果拟上市样品与关键临床试验中所用样品处方存在显著差异,应比较两种处方的溶出曲线并进行生物等效性试验。
应在适当、温和的试验条件下进行溶出度试验,比如篮法50∼100 转/分钟或桨法50∼75转/分钟,取样间隔15分钟,获得药品的溶出曲线,并在此基础上制定溶出度标准。对于快速溶出的药物制剂,可能需要以10分钟或更短的间隔期取样,以绘制获得完整的溶出曲线。对于高溶解性(BCS 1类和3类)和快速溶出的药物制剂,大多数情况下,标准中采用单点控制即可,取样时间点一般为30~60分钟,溶出限度通常应为不少于70%~85%。对于溶出较慢或水溶性差的药物(BCS 2类),根据疗效和/或副作用的特点,可采用两点检测法进行药品的溶出控制,**点在15分钟,规定一个溶出度范围,第二个取样点(30、45或60分钟)时的溶出量应不低于85%。药品在整个有效期内均应符合制定的溶出度标准。如果制剂的溶出特性在储存或运输过程中发生改变,应根据该样品与关键临床试验(或生物等效试验)用样品的生物等效性结果,决定是否变更溶出度标准。为了保证放大生产产品以及上市后发生变更的产品持续的批间生物等效性,其溶出曲线应与获得审批的生物等效批次或关键临床试验批次的溶出曲线一致。#p#分页标题#e#
(二)仿制药溶出度标准的建立
根据参比制剂是否有公开的溶出度试验方法,可考虑以下三种仿制药溶出度标准建立方法:
1.中G药典或G家药品标准收载溶出度试验方法的品种 建议采用中G药典或G家药品标准收载的方法。应取受试和参比制剂各12片(粒),按照15分钟或更短时间间隔取样,进行溶出曲线的比较。必要时,应进行不同溶出介质或试验条件下的溶出度试验,并根据试验数据确定**终的溶出度标准。复方制剂的G家药品标准未对所有成分进行溶出度测定时,应对所有成分进行溶出研究并确定在标准中是否对所有成分进行溶出度检查。
2.G家药品标准未收载溶出度试验方法但可获得参考方法的品种
建议采用G外药典或参比制剂的溶出度测定方法,应取受试和参比制剂各12片(粒),按照15分钟或更短时间间隔取样,进行溶出曲线的比较。必要时,应进行不同溶出介质或试验条件下的溶出度试验,并根据试验数据确定**终的溶出度标准。
3.缺乏可参考的溶出度试验方法的品种
建议在不同溶出度试验条件下,进行受试制剂和参比制剂溶出曲线的比较研究。试验条件可包括不同的溶出介质(pH值1.0∼6.8)、加入或不加表面活性剂、不同的溶出装臵和不同的转速。应根据生物等效性结果和其他数据制定溶出度标准。
(三)特例-两点溶出试验
对于水溶性较差的药物(如卡马西平),为保证药品的体内行为,建议采用两个时间点的溶出度试验或溶出曲线法进行质量控制。
(四)绘图或效应面法
绘图法是确定关键生产变量(CMV)与体外溶出曲线及体内生物利用度数据效应面之间相关性关系的过程。关键生产变量包括可显著影响制剂体外溶出度的制剂处方组成、工艺、设备、原材料和方法的改变(Skelly 1990, Shah 1992)。该方法的目的是制定科学、合理的溶出度标准,保证符合标准的药品具有生物等效性。已有几种试验设计可用于研究CMV对药品性能的影响。其中一种方法如下:
1.采用不同的关键生产参数制备两个或更多的样品制剂,并研究其体外溶出特征;
2.采用一定受试者(比如n≥12),对具有**快和**慢溶出度特征的样品与参比制剂或拟上市样品进行体内对比试验;
3.测定这些受试样品的生物利用度及体内外关系。具有极端溶出度特征的样品亦称为边缘产品。如果发现具有极端溶出度特征的样品与参比制剂或拟上市样品具有生物等效性,则将来生产的溶出特征符合规定的产品可保持生物等效。通过此项研究,可以为溶出度限度的合理设定提供依据。
采用绘图方法确定的药品溶出度标准可更好地确保稳定的药品质量和性能。根据研究的样品数,绘图研究可提供体内外相关性信息和/或体内数据与体外数据间的关系。(五)体内-体外相关性
对于高溶解性(BCS 1类和3类)药物,采用常规辅料和生产技术制备的普通口服固体制剂,建立体内外相关性较为困难。对于水溶性差(如BCS 2类)的药物,有可能建立体内外相关性。
对于一种药物制剂,如果能够建立其体内体外相关性,则采用溶出度试验来预测药物制剂体内行为的质控意义就会显著提高,通过体外溶出度测定就可区分合格和不合格的产品。溶出度合格的产品应是体内生物等效的产品,而不合格的产品则不具有生物等效性。为建立药品的体内体外相关性,应该**少得到三批具有不同体内或体外溶出行为的样品数据。如果这些样品的体内行为不同,可以通过调整体外溶出度试验的条件,使体外的数据能够反映体内行为的变化,从而建立体外-体内相关性。如果这些批次的体内行为没有差异,但体外溶出特性有差别,则可能需要通过调整溶出度试验条件使其体外测定结果相同。大多情况下,体外溶出度试验比体内试验具有更高的灵敏性和更强的区分能力。因此,从质量保证的角度,建议采用较灵敏的体外溶出度试验方法,这样可以在药品的体内行为受到影响之前及时发现药品质量的变动。#p#分页标题#e#
(六)溶出度标准的验证和确认
一种体外检验方法的验证,可能需要通过体内研究来确认。在此情况下,应选用处方相同但关键工艺参数不同的样品开展研究。制备两批体外溶出行为不同的样品(绘图法),进行体内测试。如果两批样品显示了不同的体内行为,则可认为该体外溶出度试验方法得到了验证。但如果两批样品的体内行为没有
差异,则可认为在绘图法中得到的溶出度数据作为溶出限度的 合理性得到确认。总之,需要对溶出度标准进行验证或者确认。
五、溶出曲线的比较
药品上市后发生较小变更时,采用单点溶出度试验可能就足以确认其是否未改变药品的质量和性能。发生较大变更时,则推荐对变更前后产品在相同的溶出条件下进行溶出曲线比较。在整体溶出曲线相似以及每一采样时间点溶出度相似时,可认为两者溶出行为相似。可采用非模型依赖法或模型依赖方法进行溶出曲线的比较。
(一)非模型依赖法
1. 非模型依赖的相似因子法
采用差异因子(f1)或相似因子(f2)来比较溶出曲线是一种简单的非模型依赖方法。差异因子(f1)法是计算两条溶出曲线在每一时间点的差异(%),是衡量两条曲线相对偏差的参数,计算公式如下:
其中n为取样时间点个数,Rt为参比样品(或变更前样品)在t时刻的溶出度值,Tt为试验批次(变更后样品)在t时刻的溶出度值。相似因子(f2)是衡量两条溶出曲线相似度的参数,计算公式如下:
其中n为取样时间点个数,Rt为参比样品(或变更前样品)在t时刻的溶出度值,Tt为试验批次(变更后样品)在t时刻的溶出度值。
差异因子和相似因子的具体测定步骤如下:
(1)分别取受试(变更后)和参比样品(变更前)各12片(粒),测定其溶出曲线。
(2)取两条曲线上各时间点的平均溶出度值,根据上述公式计算差异因子(f1)或相似因子(f2)。
(3)f1值越接近0,f2值越接近100,则认为两条曲线相似。一般情况下,f1值小于15或f2值高于50,可认为两条曲线具有相似性,受试(变更后)与参比产品(变更前)具有等效性。
这种非模型依赖方法**适合于三**四个或更多取样点的溶出曲线比较,采用本方法时应满足下列条件:
• 应在完全相同的条件下对受试和参比样品的溶出曲线进行测定。两条曲线的取样点应相同(如15、30、45、60分钟)。应采用变更前生产的**近一批产品作为参比样品。
•药物溶出量超过85%的取样点不超过一个。
• **个取样时间点(如15 分钟)的溶出量相对标准偏差不得超过20%,其余取样时间点的溶出量相对标准偏差不得超过10%。#p#分页标题#e#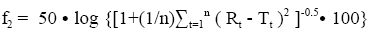
• 当受试制剂和参比制剂在15分钟内的溶出量≧85%时,可以认为两者溶出行为相似,无需进行f2的比较。
2.非模型依赖多变量臵信区间法
对于批内溶出量相对标准偏差大于15%的药品,可能更适于采用非模型依赖多变量臵信区间方法进行溶出曲线比较。建议按照下列步骤进行:
(1)测定参比样品溶出量的批间差异,然后以此为依据确定多变量统计矩(Multivariate statistical distance,MSD)的相似性限度。
(2)确定受试和参比样品平均溶出量的多变量统计矩。
(3)确定受试和参比样品实测溶出量多变量统计矩的90%臵信区间。
(4)如果受试样品的臵信区间上限小于或等于参比样品的相似性限度,可认为两个批次的样品具有相似性。
(二)模型依赖法
已有一些拟合溶出度曲线的数学模型的报道。采用这些模型比较溶出度曲线,建议采取以下步骤:
1.选择**适当的模型比较拟合标准批次、改变前批次和已批准受试批次的溶出曲线。建议采用不多于三个参数的模型(如线性模型、二次模型、对数模型、概率模型和威布尔模型)。
2.根据各样品的溶出数据绘制溶出曲线并采用**合适的模型拟合。
3.根据参比样品拟合模型的参数变异性,设定相似区间。
4.计算受试和参比样品拟合模型参数的MSD。
5.确定受试与参比样品间溶出差异的90%臵信区间。
6.比较臵信区间与相似性限度。如果臵信区间落在相似性限度内,可认为受试与参比样品具有相似的溶出曲线。
六、普通口服固体制剂上市后变更的溶出度研究
在《已上市化学药品变更研究技术指导原则》中,对于普通口服固体制剂批准上市后的变更,根据变更程度,已经对研究验证内容及申报资料要求进行了阐述。根据变更程度和药物的生物药剂学特点,指导原则中提出了相应的体外溶出度试验要求以及体内生物等效性研究要求。根据药物的治疗窗、溶解性及渗透性的不同,对体外溶出度试验条件的要求也不同。对于该指导原则中未提及的处方变更,建议在多种介质中进行溶出比较试验。对于生产场所的变更、放大设备变更和较小的工艺变更,溶出度试验应足以确认产品质量和性能是否有改变。该指导原则推荐采用非模型依赖相似因子(f2)方法进行溶出度的对比研究,以确认变更前后产品质量是否一致。
七、体内生物等效性试验的豁免
对于多规格药品,溶出度比较试验还可用于申请小剂量规格药品体内生物等效性试验的豁免。
当药物具有线性动力学的特点且不同剂量规格药品处方组成比例相似时,可对**大剂量规格的药品开展生物等效性研究,#p#分页标题#e#
基于充分的溶出度比较试验,可以豁免小剂量规格药品的体内研究。处方组成比例相似性的判定可参见《已上市化学药品变更研究技术指导原则》中“变更药品处方中已有药用要求的辅料”项下的相应内容。新增规格药品生物等效豁免与否,取决于新增规格与原进行了关键生物等效性试验规格药品的溶出曲线比较结果及处方组成的相似性。溶出曲线的比较应采用本指导原则第五部分项下所述的方法进行测定和评价。
附录溶出度试验条件
一、仪器
篮法和桨法是目前**常用的溶出度测定方法,具有装臵简单、耐用及标准化的特点,适用于大部分口服固体制剂。中G药典收载的小杯法可视为桨法,适用于低剂量规格固体制剂的溶出试验。
通常应选用中G药典收载的方法,如篮法和桨法,必要时可采用往复筒法或流通池法进行体外溶出度试验。
对于某些药品或剂型,必须采用专门的溶出装臵时,应进行详细的论证,充分评价其必要性和可行性。shou先应考虑对法定方法进行适当的改装,确定是否能满足质量控制的要求。随着对生命科学及药剂学的深入研究,可能需要对溶出度方法及试验条件进行改进,以保证获得更好的体内外相关性。
二、溶出介质
(一)溶出介质的选择
溶出度试验应尽可能在生理条件下进行,这样可以从药品体内行为的角度,更好地理解体外溶出数据。但常规的溶出度试验 条件不需要与胃肠环境严格一致,应根据药物的理化性质和口服 给药后可能的暴露条件确定适当的介质。
溶出介质的体积一般为500、900或1000 mL,溶出介质的体积**好能满足漏槽条件,一般应采用pH值1.2∼6.8的水性介质。可采用不含酶的pH 1.2、6.8的溶出介质作为人工胃液和人工肠液。特殊情况下,可采用高pH的溶出介质,但一般不应超过pH 8.0。
有研究表明,胶囊制剂在贮存过程中,由于明胶的交联作用可能会形成膜壳,因此可能需要在介质中加入胃蛋白酶或胰酶,以促使药物的溶出。但应根据具体情况考虑是否在人工胃液或人工肠液中加入酶,并充分证明其合理性。
另外,尽量不采用水作为溶出介质,因为其pH值和表面张力可能随水的来源不同而不同,且在试验过程中也可能由于药物、辅料的影响而有所改变。对于不溶于水或难溶于水的药物,可考虑在溶出介质中加入十二烷基硫酸钠或其他适当的表面活性剂,但需充分论证加入的必要性和加入量的合理性。另外,由于表面活性剂的质量可能存在明显差异,应注意不同质量的表面活性剂对试验结果带来的显著影响。使用标准化的或高纯度的表面活性剂可避免上述影响。
不建议在溶出介质中使用有机溶剂。
某些药物制剂和组分对溶出介质中溶解的空气较为敏感,因此需要进行脱气处理。
(二)溶出介质的配制
表 1 溶出介质
pH值 1.02.2 3.8 、4.0 4.55.8 6.88.0
#p#分页标题#e#
溶出介质 盐酸溶液 醋酸盐缓冲液 醋酸盐或磷酸盐缓冲液 磷酸盐缓冲液
上述各溶出介质的组成和配制详述如下: 1.盐酸溶液
取下表中规定量的盐酸,加水稀释**1000mL,摇匀,即得。
表2 盐酸溶液的配制
盐酸 (mL)
9.00
7.65
6.05
4.79
3.73
2.92
2.34
1.84
1.46
1.17
0.92
0.70
2.醋酸盐缓冲液
2mol/L醋酸溶液:取120.0g(114mL)冰醋酸用水稀释**1000mL,即得。
取下表中规定物质的取样量,加水溶解并稀释**1000mL,摇匀,即得。
表3 醋酸盐缓冲溶液的配制
pH值 醋酸钠取样量(g) 2mol/L醋酸溶液取样量
(ml)
3.8 0.67 22.6
4.0 1.22 20.5
4.5 2.99 14.0
5.5 5.98 3.0
5.8 6.23 2.1
3.磷酸盐缓冲液
0.2mol/L磷酸二氢钾溶液:取27.22g磷酸二氢钾,用水溶解并稀释**1000mL。
0.2mol/L氢氧化钠溶液:取8.00g氢氧化钠,用水溶解并稀释**1000mL。
取250mL 0.2mol/L磷酸二氢钾溶液与下表中规定量的0.2mol/L氢氧化钠溶液混合后,再加水稀释**1000mL,摇匀,即得。#p#分页标题#e#
表4 磷酸盐缓冲液
pH值 4.5 5.5
9.0
7.0 5.8 18.0 7.2 6.0 28.0 7.4 6.2 40.5 7.6 6.4 58.0 7.8 6.6 82.0 8.0 0.2mol/L氢氧化钠溶液(mL) 0 pH值 6.8
0.2mol/L氢氧化钠溶液(mL) 112.0 145.5 173.5 195.5 212.0 222.5 230.5 以上为推荐采用的溶出介质配制方法,如有特殊情况,研究者也可根据研究结果采用其他的溶出介质以及相应的配制方法。
三、温度、转速及其他
所有普通口服制剂的溶出试验均应在37±0.5℃的条件下进行。
溶出度试验过程中应采用较缓和的转速,使溶出方法具有更 好的区分能力。一般情况下篮法的转速为50∼100 转/分钟;桨 法的转速为50∼75转/分钟。
对于容易产生漂浮的片剂或胶囊,在建立溶出度测定方法时建议采用篮法。当必须采用桨法时,可使用沉降篮或其他适当的沉降装臵。
参考文献
1.Amidon, G. L., H. Lennernas, V. P. Shah, and J. R. Crison, 1995, “A Theoretical Basis For a Biopharmaceutic Drug Classification: The Correlation of In Vitro Drug ProductDissolution and In Vivo Bioavailability,” Pharmaceutical Research, 2:413-420.
2.FDA, 1995, Center for Drug Evaluation and Research, Guidance for Industry: ImmediateRelease Solid Oral Dosage Forms. Scale-up and Post-Approval Changes: Chemistry,Manufacturing and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation [SUPAC-IR], November 1995.
3.Meyer, M. C., A. B. Straughn, E. J. Jarvi, G. C. Wood, F. R. Pelsor, and V. P. Shah, 1992,“The Bioequivalence of Carbamazepine Tablets with a History of Clinical Failures,”Pharmaceutical Research, 9:1612-1616.
4.Moore, J. W. and H. H. Flanner, 1996,“Mathematical Comparison of Dissolution Profiles,”Pharmaceutical Technology, 20 (6):64-74.
5.Shah, V. P., et al., 1989, “In Vitro Dissolution Profile of Water Insoluble Drug Dosage Forms inthe Presence of Surfactants,”Pharmaceutical Research, 6:612-618.
6.Shah, V. P., et al., 1992,“Influence of Higher Rate ofAgitationon Release Patterns of Immediate Release Drug Products,”Journal of Pharmaceutical Science, 81:500-503.
7.Shah, V. P., J. P. Skelly, W. H. Barr, H. Malinowski, and G. L. Amidon, 1992,“Scale-up of Controlled Release Products
–PreliminaryConsiderations,”Pharmaceutical Technology, 16(5):35-40.
8.Shah, V. P., et al., 1995,“In Vivo Dissolution of Sparingly Water Soluble Drug Dosage Forms,” International Journal of Pharmaceutics, 125:99-106.
9.Siewert, M., 1995,“FIP Guidelines for Dissolution Testing of Solid Oral Products,”Pharm.Ind. 57:362-369.
10. Skelly, J. P., G. L. Amidon, W. H. Barr, L. Z. Benet, J. E. Carter, J. R. Robinson, V. P. Shah, and A. Yacobi, 1990,“In Vitro and In Vivo Testing and Correlation for Oral Controlled/Modified-Release Dosage Forms,”Pharmaceutical Research, 7:975-982.#p#分页标题#e#
11. G家食品药品监督管理局,已上市化学药品变更研究的技术指导原则(一),2008.
12.中G药典2010版二部附录,溶出度测定法。
13. British Pharmacopeia 2012,Dissolution test for tablets and capsules.