目录
1.概述 ......................................................... 1
1.1 仪器概况 ................................................. 1
1.2 仪器用途 ................................................. 1
2.目的 .......................................................... 1
3.范围 .......................................................... 1
4.验证小组成员及职责 ............................................. 1
5.方案执行 ...................................................... 1
6.内容 .......................................................... 1
6.1文件检查 .................................................. 1
6.2 具体确认步骤.............................................. 2
6.2.1仪器与试剂 ........................................... 2
6.2.2运行确认 ............................................. 2
6.2.3性能确认 ............................................. 3
6.3 再确认 ................................................... 4
6.4 确认结论 ................................................. 4
6.5 确认报告 ................................................. 4
7. 参考文件 ..................................................... 4
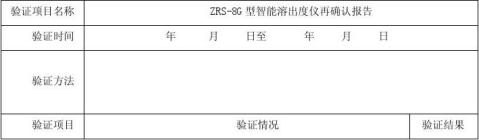
ZRS-8G型智能溶出度仪再确认记录 .................................. 6
ZRS-8G型智能溶出度仪再确认报告 ................................. 15
1.概述
ZRS-8G型智能溶出度仪为质量检测中心常用仪器,为确认该仪器仍能达到用于测定样品溶出度的要求,制订本方案对该仪器进行再确认。 1.1 仪器概况
ZRS-8G药物溶出度仪是专门用于检测固体制剂(如片剂、胶囊等)溶出度的药物试验仪器,它能摸拟人体的胃肠消化运动过程,配合紫外-可见分光光度计可检测药物制剂的溶出度。本仪器由主机、水浴箱、溶出杯、转轴等组成。
仪器主要参数如下: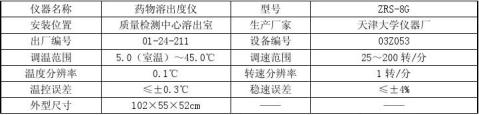
该药物溶出度仪用于测定样品的溶出度。 2.目的#p#分页标题#e#
对该仪器进行运行确认及性能确认,以确定仪器是否仍具有良好的检测性能,是否仍能满足日常分
析测试工作的需要。 3.范围
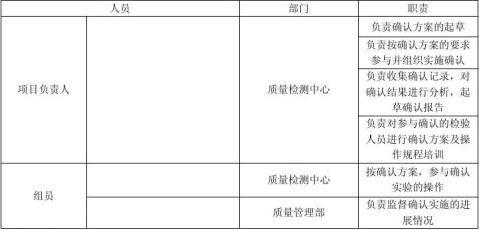
适用于ZRS-8G型智能溶出度仪的再确认。 4.验证小组成员及职责
所有的空白记录都要被填写,如果项目不适用,用单线划掉,签名并注明日期。
所有的测试项目都应完成,若未完成应记录,按偏差处理,并说明相关原因和解决的措施。
所有的偏差均要求记录,并用适当的方法评估其影响,并证明采取的纠正措施是可以被接受的。偏差记录见确认记录中“5.偏差处理记录”。 6.内容
6.1文件检查 6.1.1目的
1确保与本次再确认的相关文件都齐全。
6.1.2 程序
6.1.2.1确定仪器使用说明书等相关原始资料和技术文件齐全。
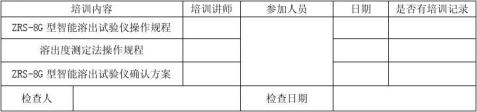
6.1.2.2相关人员接受了再确认方案及相关操作规程的培训。
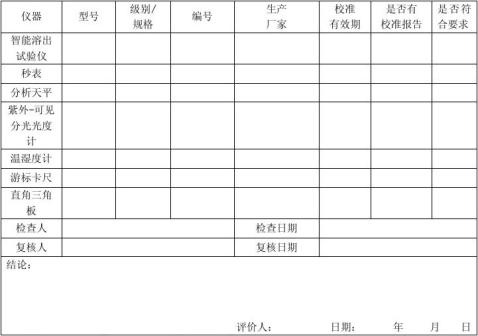
6.1.2.3确认方案中涉及的所有仪器均经过校准,并在有效期内,且有必需的相关证书。
6.1.3 可接受标准
根据确认记录中“1.文件检查记录”的要求,核对相关文件,确保文件完整。相关人员接受了确认方案及相关操作规程的培训。确保ZRS-8G型智能溶出度仪及其他仪器经过校准,在有效期内,且有相应的证书。
6.1.4 原始记录
检查记录见确认记录“1.文件检查记录”及“2.仪器与试剂”。
6.2 具体确认步骤
6.2.1仪器与试剂 6.2.1.1 要求
温湿度计;
秒表;
温度计:温度范围0~50℃、分度值0.1℃;
紫外-可见分光光度计;
分析天平:感量为0.01 mg;
游标卡尺;
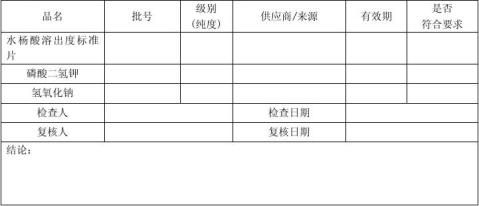
直角三角板; 水杨酸溶出度标准片:由于包装或运输过程中的碰撞可能会对片子的完整性造成影响,对于有破损的水杨酸溶出度标准片不能用于试验。
6.2.1.2具体见确认记录“2.仪器与试剂”。#p#分页标题#e#
6.2.2运行确认
6.2.2.1目的
考察ZRS-8G型智能溶出度仪的各项功能是否仍达到其设计要求,并能顺利运行。 6.2.2.2程序
6.2.2.2.1运行确认开始前状态的确认
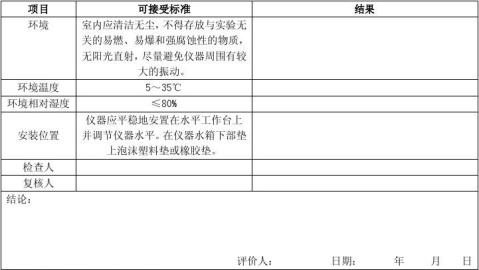
对照使用说明书,确认环境、电源等是否符合要求,具体按确认记录中“3.1运行确认开始前状态的确认”进行。
6.2.2.2.2 机械尺寸确认
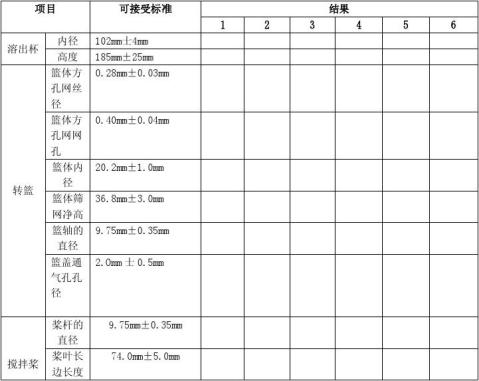
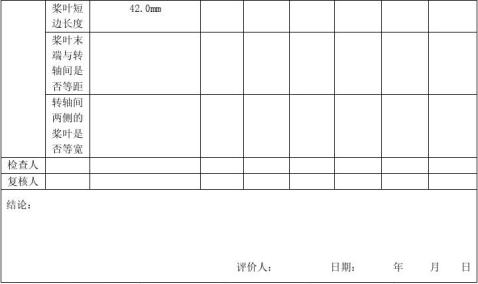
依据《中华人民共和G药典(2010版二部)》,使用游标卡尺测定溶出杯、转篮、搅拌桨的规定尺寸,具体按确认记录中“3.2 机械尺寸确认”进行。
6.2.2.2.3仪器水平的确认
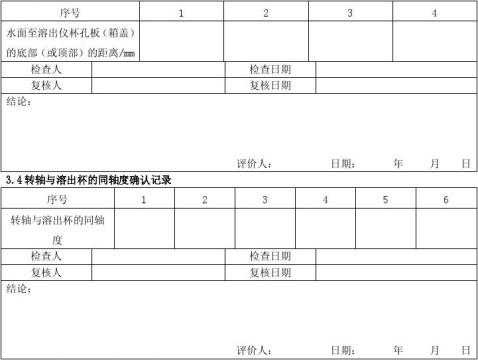
在水浴箱内加入纯化水,纯化水的加入量应能确保水位等于或略高于水浴箱内溶出杯的溶出介质高度。水面的任何一点(四角)**溶出仪杯孔板(箱盖)的底部(或顶部)的距离相等(<±1mm),表明溶出仪水平放置达到要求。否则应调整溶出仪,直到符合水平放置的要求。
6.2.2.2.4转轴与溶出杯的同轴度
仪器的每个溶出杯孔旁,有三个偏心轮,用来固定溶出杯,先将仪器所带的测同心圆的盖子放在**个溶出杯上,将转轴反过来从仪器的上端插入,直到通过同心圆盖上的孔,如位置不对,应调整三个偏心轮的位置,使溶出杯固定于中心位置上,再用同样方法调整第六个杯的位置,然后再调整其他四个杯的位置(调整后,应将每个溶出杯编号,此后如不移动溶出仪,则不需要每次都调整)。
取直角三角板,测量转轴偏离同心圆盖上孔的距离。
6.2.2.2.5通电状态及按键的确认
给仪器通电,观察显示窗、控制面板按键、水浴箱、转轴转动等的工作状态,确认仪器的主要按键及功能,具体按确认记录中“3.3通电状态及按键的确认”进行。
2
6.2.2.2.6转轴摆动幅度的确认
确认前使转篮或桨叶底部距溶出杯的内底部25mm±2mm。将仪器转速设定为100转/分,用眼睛观察,转轴运转时均不能产生明显的晃动或振动,整套装置保持平稳。(眼睛看出有晃动为2.0mm)。
6.2.2.2.7时间准确度的确认
设置运行时间为45分钟并运行,从转杆开始转动,“秒信号指示灯”开始闪亮,用秒表开始计时,当转杆停止运行,“秒信号指示灯”恒亮不闪,秒表计时停止,比较秒表与实际运行时间的时间差。
6.2.2.2.8转轴转速的确认
在转动轴上设一个固定点(如贴一小块白色橡皮膏),分别设置转速为25转/分、50转/分、100转/分、200转/分,按启停键,启动搅拌桨(或转篮),用秒表计时,目视记数检测每根转轴每分钟的转速。6个溶出杯中的转动轴,其转速均应一致。#p#分页标题#e#
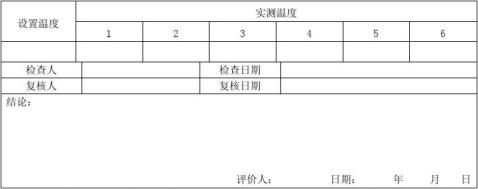
6.2.2.2.9温度均匀性的确认
将水浴箱中水位调**刻度线以上,将所规定的溶出介质脱气,并按规定量置于溶出杯中,开启仪器温度显示窗的启停键,使溶出仪处于加热控温状态,当温度达到设定温度[一般应根据室温情况,可稍高于37℃(+0.5~1.0℃),以使溶出杯中溶出介质的温度为37℃]半小时后,用0.1分度的温度计,
逐一在溶出杯中测量溶出介质的温度。
6.2.2.3可接受标准
机械尺寸:符合《中华人民共和G药典(2010版二部)》要求。
仪器水平:水位的任何一点(四角)**溶出仪杯孔板(箱盖)的底部(或顶部)的距离相等(<±1mm)。转轴与溶出杯的同轴度:≤2mm。
通电状态及按键:电源开关开启后数字显示清晰准确,仪器的主要按键及功能正常。
转轴摆动幅度:转篮摆动幅度≤±1.0mm;浆板摆动幅度≤±0.5mm。
时间准确度:误差不大于±2秒。
转轴转速:在所预设转速的±4%范围内。
温度均匀性:37℃时,六个溶出杯之间的差异应≤±0.5℃。
6.2.2.4原始记录
运行确认结果见确认记录中“3.运行确认记录”。
6.2.3性能确认
6.2.3.1目的
检查仪器在测试同一药品时是否能得到良好重现性的溶出度数据,满足准确测定溶出度的需要。
6.2.3.2性能确认开始前状态的确认
设备与电源连接正常。运行确认正常。
6.2.3.3性能测试(篮法和桨法)
6.2.3.3.1溶出介质的制备
取磷酸二氢钾6.80g,加氢氧化钠1.58g,先用尽量少的水溶解(约50ml),加煮沸并冷却**约41℃的水稀释**1000ml,即得。
6.2.3.3.2对照品溶液的制备
取水杨酸对照品约15mg,精密称定,置200ml量瓶中,加溶出介质适量,使水杨酸溶解并稀释**刻度,摇匀,作为对照品溶液。为了加快水杨酸的溶解速度,也可先用少量乙醇溶解后再用溶出介质稀释**刻度,但是乙醇的用量应不超过总体积的1%。(对照品溶液应平行制备两份)
6.2.3.3.3供试品溶液的制备
取溶出介质各900ml,分别置各溶出杯内,注意不要将空气带入溶出介质中,不要搅拌,温度平衡后,保持在37±0.5℃,调整转速为100转/分钟。用吹风机(冷风)、洗耳球或软刷小心除去片子表面的粉尘,选取水杨酸溶出度标准片 6片称重后分别置于干燥的转篮中(篮法)或同时投入六个杯中(桨法)。自标准片接触溶出介质时开始计时,经30分钟时取样(误差应不超过20秒),用不大于0.8µm孔径的滤膜滤过,取续滤液为供试品溶液。自取样**过滤应在30秒内完成。#p#分页标题#e#
6.2.3.3.4测定法
6.2.3.3.4.1数据的测定
取供试品溶液及对照品溶液,定量稀释5倍,照《紫外-可见分光光度法操作规程》(M-QC-00070), 3在296nm的波长处,采用1cm吸收池测定吸光度,按计算公式计算每片的溶出量。计算各水杨酸片溶出量的相对标准偏差(RSD)。
6.2.3.3.4.2 数据的处理
溶出量测定计算公式:
A供×900×5
每片的溶出量×100% F×M
式中:A供:30 分钟时供试品溶液的吸光度; F:两份对照品的平均响应因子F=F+F21; 2
(F1和F2的比值应在0.99~1.01范围内,否则需要检查误差来源,直到符合要求为止。) F1:**份对照品响应因子F1=A1/C1;
F2:第二份对照品响应因子F2=A2/C2;
A1:**份对照品溶液的吸光度;
A2:第二份对照品溶液的吸光度;
C1:**份对照品溶液的浓度(mg/ml);
C2:第二份对照品溶液的浓度(mg/ml);
M:每片水杨酸溶出度标准片的片重。
标准偏差∑(Xi—X)
—1
标准偏差
相对标准偏差(RSD) X
其中:X为溶出量%的平均值;
Xi为各溶出杯溶出量%的测得值。
6.2.3.4可接受标准
30分钟时每片的溶出量均应在规定的范围内:篮法应为25%~30%;桨法应25%~32%。30分钟时6片溶出量的相对标准偏差(RSD),篮法应不得过5%;桨法应不得过7%。
6.2.3.5原始记录
性能确认结果见确认记录中“4.性能确认记录”。
6.3 再确认
6.3.1 在一般正常情况下,每年再确认一次。
6.3.2 如遇任何重大变更:如更换重要零件或重大维修项目,完成后均需要再次确认,以证明各种重大变更不会对现有使用效果产生影响。#p#分页标题#e#
6.4 确认结论
确认结论见确认记录中“6. 确认结论”。
6.5 确认报告
确认报告见《ZRS-8G型智能溶出度仪再确认报告》。
7. 参考文件
本方案依据下面列出规范或资料的有关条款,结合本公司需求制定。
7.1《药品生产质量管理规范(2010年修订)》
7.2《中华人民共和G药典(2010版二部)》
7.3《药品GMP指南·质量控制实验室与物料系统》
7.4《ZRS-8G型智能溶出度仪说明书》
7.5《水杨酸溶出度标准片(校正片)说明书》
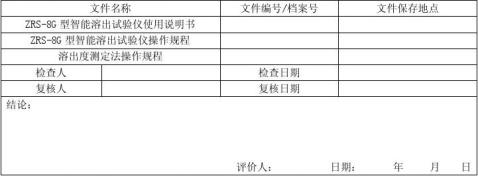
4ZRS-8G型智能溶出度仪再确认记录
1. 文件检查记录
1.1 仪器原始资料及操作规程检查




 #p#分页标题#e#
#p#分页标题#e#